Гидрирование кетонов. Альдегиды
Содержание статьи
АЛЬДЕГИДЫ И КЕТОНЫ – органические соединения, содержащие фрагмент >C=O (углерод, связанный двойной связью с кислородом, его называют карбонильным). У альдегидов карбонильный углерод соединен с атомом Н и органической группой R (общая формула RHC=O), а в кетонах – с двумя органическими группами (общая формула R 2 С=О).
Номенклатура альдегидов и кетонов. Группу –(Н)С=О называют альдегидной, для связывания с органическими группами у нее есть всего одна свободная валентность, это позволяет ей находится только на конце углеводородной цепи (но не в середине). При составлении названия альдегида указывается название соответствующего углеводорода, к которому добавляется суффикс «аль», например, метаналь Н 2 С=О, этаналь Н 3 СС(Н)=О, пропаналь Н 3 ССН 2 С(Н)=О. В более сложных случаях углеродную цепь группы R нумеруют, начиная с карбонильного углерода, затем с помощью числовых индексов указывают положение функциональных групп и различных заместителей.
Рис. 1. НОМЕНКЛАТУРА АЛЬДЕГИДОВ . Замещающие и функциональные группы, а также соответствующие им цифровые индексы выделены различающимися цветами.
Для некоторых альдегидов часто используют тривиальные (упрощенные) названия, сложившиеся исторически, например, формальдегид Н 2 С=О, ацетальдегид Н 3 СС(Н)=О, кротоновый альдегид СН 3 СН=CHC(H)=O.
В отличие от альдегидной, кетонная группа >C=O может находиться также в середине углеводородной цепи, поэтому в простых случаях указывают названия органических групп (упоминая их в порядке увеличения) и добавляют слово «кетон»: диметилкетон CH 3 –CO–CH 3 , метилэтилкетон CH 3 CH 2 –CO–CH 3 . В более сложных случаях положение кетонной группы в углеводородной цепи указывают цифровым индексом, добавляя суффикс «он ». Нумерацию углеводородной цепи начинают с того конца, который находится ближе к кетонной группе (рис. 2).

Рис. 2. НОМЕНКЛАТУРА КЕТОНОВ . Замещающие и функциональные группы и соответствующие им цифровые индексы выделены различными цветами.
Для простейшего кетона CH 3 –CO–CH 3 принято тривиальное название – ацетон.
Химические свойства альдегидов и кетонов
определяются особенностями карбонильной группы >C=O, обладающей полярностью – электронная плотность между атомами С и О распределена неравномерно, сдвинута к более электроотрицательному атому О. В результате карбонильная группа приобретает повышенную реакционную способность, что проявляется в разнообразных реакциях присоединения по двойной связи. Во всех случаях кетоны менее реакционноспособны, чем альдегиды, в частности, из-за пространственных затруднений, создаваемых двумя органическими группами R, наиболее легко участвует в реакциях формальдегид Н 2 С=О.
1. Присоединение по двойной связи С=О.
При взаимодействии со спиртами альдегиды образуют полуацетали – соединения, содержащие одновременно алкокси- и гидрокси-группу у одного атома углерода: >C(OH)OR. Полуацетали могут далее реагировать с еще одной молекулой спирта, образуя полные ацетали – соединения, где у одного атома углерода находятся одновременно две RО-группы: >C(OR) 2 . Реакцию катализируют кислоты и основания (рис. 3А). В случае кетонов присоединение спиртов к двойной связи в С=О затруднено.
Сходным образом альдегиды и кетоны реагируют с синильной кислотой HCN, образуя гидроксинитрилы – соединения, содержащие у одного атома углерода ОН- и CN-группу: >C(OH)Cє N (рис. 3Б). Реакция примечательна тем, что позволяет увеличивать углеродную цепь (возникает новая связь С-С).
Точно так же (раскрывая двойную связь С=О) аммиак и амины реагируют с альдегидами и кетонами, продукты присоединения неустойчивы и конденсируются с выделением воды и образованием двойной связи C=N. В случае аммиака получаются имины (рис. 3В), а из аминов образуются так называемые основания Шиффа – соединения, содержащие фрагмент >C=NR (рис. 3Г). Продукт взаимодействия формальдегида с аммиаком несколько иной – это результат циклизации трех промежуточных молекул, в результате получается каркасное соединение гексаметилентетрамин, используемое в медицине как препарат уротропин (рис. 3Д).

2. Реакции конденсации. Для альдегидов и кетонов возможна конденсация, проходящая между двумя молекулами одного и того же соединения. При такой конденсации альдегидов двойная связь одной из молекул раскрывается, образуется соединение, содержащее одновременно альдегидную и ОН-группу, называемое альдолем (альдегидоспирт). Протекающую конденсацию называют, соответственно, альдольной, эту реакцию катализируют основания (рис. 4А). Полученный альдоль может далее конденсироваться с образованием двойной связи С=С и выделением конденсационной воды. В итоге получается ненасыщенный альдегид (рис. 4А, кротоновой альдегид). Такую конденсацию называют кротоновой по названию первого соединения в ряду ненасыщенных альдегидов. Кетоны также способны участвовать в альдольной конденсации (рис. 4Б), а вторая стадия – кротоновая конденсация, для них затруднена. В альдольной конденсации могут совместно участвовать молекулы различных альдегидов, а также одновременно альдегид и кетон, во всех случаях происходит удлинение углеродной цепи. Получившийся на последней стадии (рис. 4А) кротоновый альдегид, обладая всеми свойствами альдегидов, может далее участвовать в альдольной и кротоновой конденсации при взаимодействии с очередной порцией ацетальдегида, из которого он и был получен (рис. 4В). Таким способом можно удлинять углеводородную цепь, получая соединения, в которых чередуются простые и двойные связи: –СН=СН–СН=СН–.

Конденсация альдегидов и кетонов с фенолами идет с удалением карбонильного атома О (в виде воды), а метиленовая группа СН 2 или замещенная метиленовая группа (СНR либо СR 2) встраивается между двумя молекулами фенола. Наиболее широко эту реакцию применяют для получения фенолоформальдегидных смол (рис. 5.).

Рис. 5. КОНДЕНСАЦИЯ ФЕНОЛА С ФОРМАЛЬДЕГИДОМ
3. Полимеризация карбонильных соединений протекает с раскрытием двойной связи С=О и свойственна, в основном, альдегидам. При упаривании в вакууме водных растворов формальдегида образуется смесь циклических соединений (в основном, триоксиметилен) и линейных продуктов с незначительной длиной цепи n = 8–12 (параформ). Полимеризацией циклического продукта получают полиформальдегид (рис. 6) – полимер с высокой прочностью и хорошими электроизоляционными свойствами, используемый как конструкционный материал в машино- и приборостроении.

Рис. 6. ПРОДУКТЫ ПОЛИМЕРИЗАЦИИ ФОРМАЛЬДЕГИДА
4. Восстановление и окисление. Альдегиды и кетоны представляют собой как бы промежуточные соединения между спиртами и карбоновыми кислотами : восстановление приводит к спиртам, а окисление –- к карбоновым кислотам. При действии Н 2 (в присутствии катализатора Pt или Ni) либо других восстанавливающих реагентов, например, LiAlH 4 , альдегиды восстанавливаются, образуя первичные спирты, а кетоны – вторичные спирты (рис. 7, схемы А и Б).
Окисление альдегидов до карбоновых кислот проходит достаточно легко в присутствии О 2 или при действии слабых окислителей, таких как аммиачный раствор гидроксида серебра (рис. 7В). Эта эффектная реакция сопровождается образованием серебряного зеркала на внутренней поверхности реакционного прибора (чаще, обычной пробирки), ее используют для качественного обнаружения альдегидной группы. В отличие от альдегидов, кетоны более устойчивы к окислению, при их нагревании в присутствии сильных окислителей, например, КМnО 4 , образуются смеси карбоновых кислот, имеющих укороченную (в сравнении с исходным кетоном) углеводородную цепь.

Рис. 7. ВОССТАНОВЛЕНИЕ И ОКИСЛЕНИЕ АЛЬДЕГИДОВ И КЕТОНОВ
Дополнительным подтверждением того, что альдегиды занимают промежуточное положение между спиртами и кислотами, служит реакция, в результате которой из двух молекул альдегида получаются спирт и карбоновая кислота (рис. 8А), т.е. одна молекула альдегида окисляется, а другая восстанавливается. В некоторых случаях два полученных соединения – спирт и карбоновая кислота – далее реагируют между собой, образуя сложный эфир (рис.8Б).

Рис. 8. ПРОТЕКАЮЩЕЕ ОДНОВРЕМЕННО ОКИСЛЕНИЕ И ВОССТАНОВЛЕНИЕ АЛЬДЕГИДОВ
Получение альдегидов и кетонов.
Наиболее универсальный способ – окисление спиртов, при этом из первичных спиртов образуются альдегиды, а из вторичных – кетоны (рис. 9А и Б). Это реакции, обратные реакциям на рис. 7А и Б. Реакция поворачивает «вспять», если изменен действующий реагент (окислитель вместо восстановителя) и катализатор, при окислении спиртов эффективен медный катализатор.
В промышленности ацетальдегид получают окислением этилена (рис. 9В), на промежуточной стадии образуется спирт, у которого ОН-группа «примыкает» к двойной связи (виниловый спирт), такие спирты неустойчивы и сразу изомеризуются в карбонильные соединения. Другой способ – каталитическая гидратация ацетилена (рис. 9Г), промежуточное соединение – виниловый спирт. Если вместо ацетилена взять метилацетилен, то получится ацетон (рис. 9Д). Промышленный способ получения ацетона – окислением кумола. Ароматические кетоны, например, ацетофенон, получают каталитическим присоединением ацетильной группы к ароматическому ядру (рис. 9Е).

Применение альдегидов и кетонов.
Формальдегид Н 2 С=О (его водный раствор называют формалином) используют как дубитель кожи и консервант биологических препаратов.
Ацетон (СН 3) 2 С=О – широко применяемый экстрагент и растворитель лаков и эмалей.
Ароматический кетон бензофенон (С 6 Н 5) 2 С=О с запахом герани, используется в парфюмерных композициях и для ароматизации мыла.
Некоторые из альдегидов были сначала найдены в составе эфирных масел растений, а позже искусственно синтезированы.
Алифатический альдегид СН 3 (СН 2) 7 С(Н)=О (тривиальное название – пеларгоновый альдегид) содержится в эфирных маслах цитрусовых растений, обладает запахом апельсина, его используют как пищевой ароматизатор.
Ароматический альдегид ванилин (рис. 10) содержится в плодах тропического растения ванили, сейчас чаще используется синтетический ванилин – широко известная ароматизирующая добавка в кондитерские изделия (рис. 10).

Рис. 10. ВАНИЛИН
Бензальдегид С 6 Н 5 С(Н)=О с запахом горького миндаля содержится в миндальном масле и в эфирном масле эвкалипта. Синтетический бензальдегид используется в пищевых ароматических эссенциях и в парфюмерных композициях.
Бензофенон (С 6 Н 5) 2 С=О и его производные способны поглощать УФ-лучи, что определило их применение в кремах и лосьонах от загара, кроме того, некоторые производные бензофенона обладают противомикробной активностью и применяются в качестве консервантов. Бензофенон обладает приятным запахом герани, и потому его используют в парфюмерных композициях и для ароматизации мыла.
Способность альдегидов и кетоновучаствовать в различных превращениях определила их основное применение в качестве исходных соединений для синтеза разнообразных органических веществ: спиртов, карбоновых кислот и их ангидридов, лекарственных препаратов (уротропин), полимерных продуктов (фенолоформальдегидные смолы, полиформальдегид), в производстве всевозможных душистых веществ (на основе бензальдегида) и красителей.
Михаил Левицкий
Альдегиды и кетоны имеют в своем составе карбонильную функциональную группу >С=О и относятся к классу карбонильных соединений. Также их называют оксосоединениями. Несмотря на то что эти вещества относятся к одному классу, из-за особенностей строения их все же разделяют на две большие группы.
В кетонах атом углерода из группы >С=О соединен с двумя одинаковыми или различными углеводородными радикалами, обычно они имеют вид: R-СО-R". Такую форму карбонильной группы называют еще кетогруппой или оксогруппой. В альдегидах же карбонильный углерод соединен только с одним углеводородным радикалом, а оставшаяся валентность занимается атомом водорода: R-СОН. Такую группу принято называть альдегидной. Благодаря этим различиям в строении альдегиды и кетоны ведут себя немного по-разному при взаимодействии с одними и теми же веществами.
Карбонильная группа
Атомы С и О в этой группе находятся в sp 2 -гибридизированном состоянии. Углерод за счет sp 2 -гибридных орбиталей имеет 3 σ-связи, расположенные под углом примерно в 120 градусов в одной плоскости.
Атом кислорода обладает гораздо большей электроотрицательностью, чем углеродный атом, а поэтому стягивает на себя подвижные электроны π-связи в группе >С=О. Поэтому на атоме О возникает избыточная электронная плотность δ - , а на атоме С, напротив, происходит ее уменьшение δ + . Этим и объясняются особенности свойств альдегидов и кетонов.
Двойная связь С=О более прочная, чем С=С, но вместе с тем и более реакционно способная, что объясняется большой разницей в электроотрицательностях атомов углерода и кислорода.
Номенклатура
Как и для всех других классов органических соединений, существуют различные подходы к наименованию альдегидов и кетонов. В соответствии с положениями номенклатуры ИЮПАК, наличие альдегидной формы карбонильной группы обозначается суффиксом -аль, а кетонной -он. Если карбонильная группа является старшей, то она определяет порядок нумерации атомов С в основной цепи. В альдегидной карбонильный атом углерода является первым, а в кетонах атомы С нумеруют с того края цепи, к которому ближе группа >С=О. С этим связана необходимость обозначать положение карбонильной группы в кетонах. Делают это, записывая соответствующую цифру после суффикса -он.
Если карбонильная группа не является старшей, то по правилам ИЮПАК ее наличие указывают приставкой -оксо для альдегидов и -оксо (-кето) для кетонов.
Для альдегидов широко применяют тривиальные названия, получаемые от наименования кислот, в которые они способны превращаться при окислении с заменой слова "кислота" на "альдегид":
- СΗ 3 -СОН уксусный альдегид;
- СΗ 3 -СН 2 -СОН пропионовый альдегид;
- СΗ 3 -СН 2 -СН 2 -СОН масляный альдегид.
Для кетонов распространены радикально функциональные названия, которые складываются из наименований левого и правого радикалов, соединенных с карбонильным атомом углерода, и слова "кетон":
- СΗ 3 -СО-СН 3 диметилкетон;
- СΗ 3 -СΗ 2 -СО-СН 2 -СН 2 -СН 3 этилпропилкетон;
- С 6 Η 5 -СО-СΗ 2 -СΗ 2 -СΗ 3 пропилфенилкетон.
Классификация
В зависимости от характера углеводородных радикалов класс альдегидов и кетонов делят на:
- предельные - атомы С связаны друг с другом только одинарными связями (пропаналь, пентанон);
- непредельные - между атомами С имеются двойные и тройные связи (пропеналь, пентен-1-он-3);
- ароматические - содержат в своей молекуле бензольное кольцо (бензальдегид, ацетофенон).
По числу карбонильных и наличию других функциональных групп различают:
- монокарбонильные соединения - содержат только одну карбонильную группу (гексаналь, пропанон);
- дикарбонильные соединения - содержат две карбонильные группы в альдегидной и/или кетонной форме (глиоксаль, диацетил);
- карбонильные соединения, содержащие также другие функциональные группы, которые, в свою очередь, делятся на галогенкарбонильные, гидроксикарбонильные, аминокарбонильные и т.д.
Изомерия
Наиболее характерной для альдегидов и кетонов является структурная изомерия. Пространственная возможна тогда, когда в углеводородном радикале присутствует асимметрический атом, а также двойная связь с различными заместителями.
- Изомерия углеродного скелета. Наблюдается у обоих типов рассматриваемых карбонильных соединений, но начинается с бутаналя в альдегидах и с пентанона-2 в кетонах. Так, бутаналь СН 3 -СΗ 2 -СΗ 2 -СОН имеет один изомер 2-метилпропаналь СΗ 3 -СΗ(СΗ 3)-СОН. А пентанон-2 СΗ 3 -СО-СΗ 2 -СΗ 2 -СΗ 3 изомерен 3-метилбутанону-2 СΗ 3 -СО-СΗ(СΗ 3)-СΗ 3 .
- Межклассовая изомерия. Оксосоединения с одинаковым составом изомерны между собой. Например, составу С 3Η 6 О соответствуют пропаналь СН 3 -СΗ 2 -СОН и пропанон СΗ 3 -СО-СΗ 3 . А молекулярная формула альдегидов и кетонов С 4 Н 8 О подходит бутаналю СН 3 -СΗ 2 -СΗ 2 -СОН и бутанону СН 3 -СО-СΗ 2 -СΗ 3 .
Также межклассовыми изомерами для карбоксильных соединений являются циклические оксиды. Например, этаналь и этиленоксид, пропанон и пропиленоксид. Кроме того, непредельные спирты и простые эфиры также могут иметь общий состав и оксосоединениями. Так, молекулярную формулу С 3 Н 6 О имеют:
- СΗ 3 -СΗ 2 -СОН - пропаналь;
- СΗ 2 =СΗ-СΗ 2 -ОН - ;
- СΗ 2 =СΗ-О-СН 3 - метилвиниловый эфир.
Физические свойства
Несмотря на то что молекулы карбонильных веществ полярны, в отличие от спиртов, альдегиды и кетоны не имеют подвижного водорода, а значит, не образуют ассоциатов. Следовательно, температуры плавления и кипения их несколько ниже, чем у соответствующих им спиртов.
Если сравнивать альдегиды и того же состава кетоны, то у последних t кип несколько выше. С увеличением молекулярной массы t пл и t кип оксосоединений закономерно повышаются.

Низшие карбонильные соединения (ацетон, формальдегид, уксусный альдегид) хорошо растворимы в воде, высшие же альдегиды и кетоны растворяются в органических веществах (спиртах, эфирах и т.д.).
Пахнут оксосоединения весьма различно. Низшие их представители имеют резкие запахи. Альдегиды, содержащие от трех до шести атомов С, пахнут очень неприятно, а вот высшие их гомологи наделены цветочными ароматами и даже применяются в парфюмерии.
Реакции присоединения
Химические свойства альдегидов и кетонов обусловлены особенностями строения карбонильной группы. Из-за того, что двойная связь С=О сильно поляризована, то под действием полярных агентов она легко переходит в простую одинарную связь.
1. Взаимодействие с Присоединение HCN в присутствии следов щелочей происходит с образованием циангидринов. Щелочь добавляют для повышения концентрации ионов CN - :
R-СОН + NCN ―> R-СН(ОН)-CN
2. Присоединение водорода. Карбонильные соединения легко могут восстанавливаться до спиртов, присоединяя водород по двойной связи. При этом из альдегидов получают первичные спирты, а из кетонов - вторичные. Реакции катализируются никелем:
Н 3 С-СОН + Н 2 ―> Н 3 С-СΗ 2 -ОΗ
Η 3 С-СО-СΗ 3 + Η 2 ―> Н 3 С-СΗ(ОΗ)-СΗ 3
3. Присоединение гидроксиламинов. Эти реакции альдегидов и кетонов катализируются кислотами:
Н 3 С-СОН + NH 2 OH ―> Η 3 С-СΗ=N-ОН + Н 2 О
4. Гидратация. Присоединение молекул воды к оксосоединениям приводит к образованию гем-диолов, т.е. таких двухатомных спиртов, в которых две гидроксильные группы присоединены к одному атому углерода. Однако такие реакции обратимы, полученные вещества тут же распадаются с образованием исходных веществ. Электроноакцепторные группы в данном случае смещают равновесие реакций в сторону продуктов:
>С=О + Η 2 <―> >С(ОΗ) 2
5. Присоединение спиртов. В ходе этой реакции могут получаться различные продукты. Если к альдегиду присоединяется две молекулы спирта, то образуется ацеталь, а если только одна, то полуацеталь. Условием проведения реакции является нагревание смеси с кислотой или водоотнимающим агентом.
R-СОН + НО-R" ―> R-СН(НО)-О-R"
R-СОН + 2НО-R" ―> R-СН(О-R") 2
Альдегиды с длинной углеводородной цепью склонны к внутримолекулярной конденсации, в результате которой образуются циклические ацетали.
Качественные реакции
Понятно, что при отличающейся карбонильной группе в альдегидах и кетонах химия их тоже различна. Порой необходимо понять, к какому из этих двух типов относится полученное оксосоединение. легче, чем кетоны, происходит это даже под действием оксида серебра или гидроксида меди (II). При этом карбонильная группа изменяется в карбоксильную и образуется карбоновая кислота.
Реакцией серебряного зеркала принято называть окисление альдегидов раствором оксида серебра в присутствии аммиака. Фактически в растворе образуется комплексное соединение, которое и воздействует на альдегидную группу:
Ag 2 O + 4NH 3 + Н 2 О ―> 2ОΗ
СΗ 3 -СОΗ + 2ОΗ ―> СН 3 -СОО-NH 4 + 2Ag + 3NH 3 +Н 2 О
Чаще записывают суть происходящей реакции более простой схемой:
СΗ 3 -СОΗ + Ag 2 O ―> СΗ 3 -СООΗ + 2Ag
В ходе реакции окислитель восстанавливается до металлического серебра и выпадает в осадок. При этом на стенках реакционного сосуда образуется тонкий серебряный налет, похожий на зеркало. Именно за это реакция и получила свое название.

Еще одной качественной реакцией, указывающей на разницу в строении альдегидов и кетонов, является действие на группу -СОН свежим Cu(OΗ) 2 . Готовят его добавлением щелочей к растворам солей меди двухвалентной. При этом образуется голубая суспензия, которая при нагревании с альдегидами меняет окраску на красно-коричневую за счет образования оксида меди (I):
R-СОН + Cu(OΗ) 2 ―> R-СООΗ + Cu 2 O + Η 2 О
Реакции окисления
Оксосоединения можно окислить раствором KMnO 4 при нагревании в кислой среде. Однако кетоны при этом разрушаются с образованием смеси продуктов, которые не имеют практической ценности.
Химическая реакция, отражающая данное свойство альдегидов и кетонов, сопровождается обесцвечиванием розоватой реакционной смеси. При этом из подавляющего большинства альдегидов получаются карбоновые кислоты:
СН 3 -СОН + KMnO 4 + H 2 SO 4 ―> СН 3 -СОН + MnSO 4 + K 2 SO 4 + Н 2 О
Формальдегид в ходе данной реакции окисляется до муравьиной кислоты, которая под действием окислителей распадается с образованием углекислого газа:
Н-СОН + KMnO 4 + H 2 SO 4 ―> СО 2 + MnSO 4 + K 2 SO 4 + Н 2 О
Для альдегидов и кетонов характерно полное окисление в ходе реакций горения. При этом образуются СО 2 и вода. Уравнение горения формальдегида имеет вид:
НСОН + O 2 ―> СО 2 + Н 2 О

Получение
В зависимости от объемов продуктов и целей их использования способы получения альдегидов и кетонов делят на промышленные и лабораторные. В химическом производстве карбонильные соединения получают окислением алканов и алкенов (нефтепродуктов), дегидрированием первичных спиртов и гидролизом дигалогеналканов.
1. Получение формальдегида из метана (при нагревании до 500 °С в присутствии катализатора):
СΗ 4 + О 2 ―> НСОН + Η 2 О.
2. Окисление алкенов (в присутствии катализатора и высокой температуре):
2СΗ 2 =СΗ 2 + О 2 ―> 2СН 3 -СОН
2R-СΗ=СΗ 2 + О 2 ―> 2R-СΗ 2 -СОΗ

3. Отщепление водорода от первичных спиртов (катализируется медью, необходимо нагревание):
СΗ 3 -СΗ 2 -ОН ―> СН 3 -СОН + Η 2
R-СН 2 -ОН ―> R-СОН + Н 2
4. Гидролиз дигалогеналканов щелочами. Обязательным условием является присоединенность обоих атомов галогенов к одному и тому же атому углерода:
СΗ 3 -C(Cl) 2 H + 2NaOH ―> СΗ 3 -СОΗ + 2NaCl + Н 2 О
В небольших количествах в лабораторных условиях карбонильные соединения получают гидратацией алкинов или окислением первичных спиртов.
5. Присоединение воды к ацетиленам происходит в присутствии в кислой среде (реакция Кучерова):
ΗС≡СΗ + Η 2 О ―> СН 3 -СОΗ
R-С≡СΗ + Η 2 О ―> R-СО-СН 3
6. Окисление спиртов с концевой гидроксильной группой проводят с использованием металлических меди или серебра, оксида меди (II), а также перманганатом или дихроматом калия в кислой среде:
R-СΗ 2 -ОΗ + О 2 ―> R-СОН + Н 2 О
Применение альдегидов и кетонов
Необходим для получения фенолформальдегидных смол, получаемых в ходе реакции его конденсации с фенолом. В свою очередь образующиеся полимеры необходимы для производства разнообразных пластмасс, древесно-стружечных плит, клея, лаков и многого другого. Также он применяется для получения лекарственных средств (уротропина), дезинфицирующих средств и используется для хранения биологических препаратов.

Основная часть этаналя идет на синтез уксусной кислоты и других органических соединений. Некоторые количества ацетальдегида используют в фармацевтическом производстве.
Ацетон широко применяется для растворения многих органических соединений, в числе которых лаки и краски, некоторых видов каучуков, пластмасс, природных смол и масел. Для этих целей он используется не только чистым, но и в смеси с другими органическими соединениями в составе растворителей марок Р-648, Р-647, Р-5, Р-4 и др. Также его используют для обезжиривания поверхностей при изготовлении различных деталей и механизмов. Большие количества ацетона требуются для фармацевтического и органического синтеза.
Многие альдегиды обладают приятными ароматами, благодаря чему применяются в парфюмерной промышленности. Так, цитраль имеет лимонный запах, бензальдегид пахнет горьким миндалем, фенилуксусный альдегид привносит в композицию аромат гиацинта.

Циклогексанон нужен для производства многих синтетических волокон. Из него получают адипиновую кислоту, в свою очередь применяемую как сырье для капролактама, нейлона и капрона. Также он используется в качестве растворителя жиров, природных смол, воска и ПВХ.
К классу оксосоединений относятся органические вещества, содержащие группу >С=О, называемую карбонильной группой или карбонилом.
Если две валентности атома углерода карбонила заняты алкильными радикалами, оксосоединения называются кетонами:
Если две валентности атома углерода карбонила заняты алкильным радикалом и атомом водорода, оксосоединения называются альдегидами.
Кетоны и альдегиды называют также карбонильными соединениями.
Реакции альдегидов и кетонов весьма похожи, что и позволяет рассматривать их в общем классе оксосоединений. Общая формула гомологического ряда наиболее распространенных предельных алифатических альдегидов и кетонов одинакова: С n Н 2п О.
1. Номенклатура
а) Тривиальные названия альдегидов очень распространены, они связаны с тривиальными наименованиями кислот с тем же углеродным скелетом, в которые альдегиды легко переходят при окислении: муравьиный альдегид (формальдегид), уксусный альдегид (ацетальдегид), пропионовый, масляный, валериановый и т. д.
По номенклатуре ИЮПАК наличие альдегидной группы обозначается суффиксом -ал (-алъ):

Если альдегидная группа не входит в главную цепь из-за наличия старших групп, то она обозначается префиксом формил:

б)Названия простых кетонов обычно составляются из названий радикалов, связанных с карбонильной группой, и слова кетон:

Для названий более сложных кетонов используют суффикс -он (ИЮПАК):

При наличии более старшей группы кетонная группа обозначается префиксом оксо-:

2. Физические свойства
В молекуле любого альдегида или кетона в связи с большей электроотрицательностью атома кислорода по сравнению с углеродным атомом подвижные электроны π-связи в группе >С=0 сдвинуты в сторону атома кислорода. Этот сдвиг вызывает появление избыточной электронной плотности на атоме кислорода (δ-) и соответственное уменьшение электронной плотности на карбонильном атоме углерода (δ+), что вызывает в свою очередь смещение σ-электронов соседних углерод-углеродных связей:

Таким образом, альдегиды и кетоны - полярные вещества с избыточной электронной плотностью на атоме кислорода. Практически все химические реакции оксосоединений обусловлены таким распределением электронной плотности в молекуле.
Двойная связь С=0 является одновременно и более реак-ционноспособной и более прочной, чем связь С=С. Так, энергия связи С=О равна 750 кДж/моль, что заметно больше, чем удвоенная энергия связи С-О, равная 360 2 = 720 кДж/моль. В ряду связей С=С и С-С обратное соотношение. Энергия связи С=С (612 кДж/моль) заметно меньше, чем удвоенная энергия связи С-С (339 2 = 678 кДж/моль). Повышенная реакционная способность связи С=О по сравнению с С=С определяется различием в электроотрицательности атомов О и С. Высокая степень поляризации связи С=О и приводит к легкому присоединению к ней полярных соединений или ионов.
Так как в молекулах альдегидов и кетонов в отличие от спиртов нет подвижных атомов водорода, их молекулы не ассоциированы и температуры кипения их значительно ниже, чем соответствующих спиртов. В целом температура кипения кетонов немного выше, чем изомерных им альдегидов. Разветвление цепи вызывает закономерное понижение температуры кипения. Низшие члены ряда - ацетон, формальдегид, ацетальдегид - растворимы в воде, высшие альдегиды и кетоны хорошо растворимы в большинстве обычных органических растворителей (спирты, эфир и т. п.). Низшие альдегиды имеют резкий запах, у альдегидов с С 3 -С 6 весьма неприятный запах, высшие альдегиды обладают цветочными запахами и даже применяются в парфюмерии.
Первая группа свойств реакции присоединения. В карбонильной группе между углеродом и кислородом присутствует двойная связь, которая, как вы помните, состоит из сигма-связи и пи-связи. В реакциях присоединения пи-связь рвется и образуются две сигма связи одна с углеродом, вторая с кислородом. На углероде сосредоточен частичный положительный заряд, на кислороде частичный отрицательный. Поэтому к углероду присоединяется отрицательно заряженная частица реагента, анион, а к кислород положительно заряженная часть молекулы.
Первое свойство гидрирование, присоединение водорода.
Реакция проходит при нагревании. Применяется уже известный вам катализатор гидрирования никель. Из альдегидов получаются первичные спирты, из кетонов вторичные.

У вторичных спиртов гидроксогруппа связана со вторичным атомом углерода.
Второе свойство гидратация, присоединение воды. Эта реакция возможна только для формальдегида и ацетальдегида. Кетоны совсем не реагируют с водой.
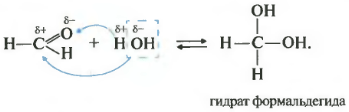
Все реакции присоединения идут таким образом, что плюс идет к минусу, а минус к плюсу.
Как вы помните из видео про спирты , наличие двух гидроксогрупп у одного атома почти невозможная ситуация, такие вещества крайне неустойчивы. Так вот конкретно два этих случая гидрат формальдегида и уксусного альдегида возможны, хотя и существуют только в растворе.
Сами реакции знать не обязательно. Скорее всего, вопрос на экзамене может звучать как констатация факта, допустим, с водой реагируют и перечислены вещества. Среди их перечня которых могут быть метаналь или этаналь.
Третье свойство присоединение синильной кислоты.

Снова плюс идет к минусу, а минус к плюсу. Получаются вещества, называемые гидроксинитрилами. Опять же, сама реакция встречается нечасто, но знать об этом свойстве нужно.
Четвертое свойство присоединение спиртов.
Здесь снова не нужно знать наизусть уравнение реакции, просто надо понимать, что такое взаимодействие возможно.

Как обычно в реакциях присоединения к карбонильной группе плюс к минусу, а минус к плюсу.
Пятое свойство реакция с гидросульфитом натрия.

И снова, реакция довольно сложная, выучить ее вряд ли получится, но это одна из качественных реакций на альдегиды, потому что полученная натриевая соль выпадает в осадок. То есть по факту вы должны знать, что альдегиды реагируют с гидросульфитом натрия, этого будет достаточно.
На этом закончим с первой группой реакций. Вторая группа реакции полимеризации и поликонденсации.
2. Полимеризация и поликонденсация альдегидов
С полимеризацией вы знакомы: полиэтилен, бутадиеновый и изопреновый каучуки, поливинилхлорид это продукты объединения множества молекул (мономеров) в одну большую, в единую полимерную цепь. То есть получается один продукт. При поликонденсации происходит то же самое, но помимо полимера получаются еще низкомолекулярные продукты, например, вода. То есть получается два продукта.
Итак, шестое свойство полимеризация. Кетоны в эти реакции не вступают, промышленное значение имеет только полимеризация формальдегида.
Пи-связь рвется и образуются две сигма связи с соседними мономерами. Получается полиформальдегид, называемый также параформ. Вероятнее всего, вопрос на экзамене может звучать так: в реакции полимеризации вступают вещества. И приведен список веществ, среди которых может быть в формальдегид.
Седьмое свойство поликонденсация. Еще раз: при поликонденсации помимо полимера получается еще низкомолекулярное соединение, например, вода. Формальдегид вступает в такую реакцию с фенолом. Для наглядности сначала запишем уравнение с двумя молекулами фенола.
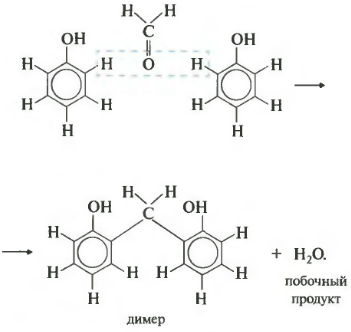
В результате получается такой димер и отщепляется молекула воды. Теперь запишем уравнение реакции в общем виде.

Продуктом поликонденсации является феноло-формальдегидная смола. Она находит широкое применение от клеев и лаков до пластмасс и компонента древесно-стружечных плит.
Теперь третья группа свойств реакции окисления.
3. Окисление альдегидов и кетонов
Восьмой реакцией в общем списке является качественная реакция на альдегидную группу окисление аммиачным раствором оксида серебра. Реакция «серебряного зеркала». Скажу сразу, кетоны не вступают в эту реакцию, только альдегиды.

Альдегидная группа окисляется до карбоксильной, кислотной группы, но в присутствии аммиака, который является основание, сразу же происходит реакция нейтрализации и получается соль ацетат аммония. Серебро выпадает в осадок, покрывая пробирку изнутри и создавая зеркальную поверхность. Эта реакция встречается на ЕГЭ постоянно.
Кстати, эта же реакция является качественной на другие вещества, имеющие альдегидную группу, например, на муравьиную кислоту и ее соли, а также на глюкозу.
Девятая реакция тоже качественная на альдегидную группу окисление свежеосажденным гидроксидом меди два. Здесь тоже замечу, что кетоны не вступают в эту реакцию.

Визуально будет наблюдаться сначала образование желтого осадка, который потом становится красным. В некоторых учебниках встречается информация, что сначала образуется гидроксид меди один, имеющий желтый цвет, который затем распадается на красный оксид меди один и воду. Так вот это неверно по последним данным в процессе выпадения осадка меняется размер частиц оксида меди один, которые в конечном счете достигают размеров, окрашенных именно в красный цвет. Альдегид окисляется до соответствующей карбоновой кислоты. Реакция встречается на егэ очень часто.
Десятая реакция окисление альдегидов подкисленным раствором перманганата калия при нагревании.
Происходит обесцвечивание раствора. Альдегидная группа окисляется до карбоксильной, то есть альдегид окисляется до соответствующей кислоты. Для кетонов эта реакция не имеет практического смысла, поскольку происходит разрушение молекулы и в результате получается смесь продуктов.
Важно отметить, что муравьиный альдегид, формальдегид, окисляется до углекислого газа, потому как соответствующая ему муравьиная кислота сама не устойчива к действию сильных окислителей.
В итоге углерод переходит из степени окисления 0 в степень окисления +4. Напомню, что и метанол, как правило, в таких условиях окисляется по максимуму до CO 2 , проскакивая стадию и альдегида, и кислоты. Эту особенность надо запомнить.
Одиннадцатая реакция горение, полное окисление. И альдегиды, и кетоны сгорают до углекислого газа и воды.
Запишем уравнение реакции в общем виде.
По закону сохранения массы атомов слева должно быть столько же, сколько атомов справа. Потому что ведь в химических реакциях атомы никуда не деваются, а просто изменяется порядок связей между ними. Так вот молекул углекислого газа будет столько же, сколько и атомов углерода в молекуле карбонильного соединения, поскольку в состав молекулы входит один атом углерода. То есть n молекул CO 2 . Молекул воды будет в два раза меньше, чем атомов водорода, то есть 2n/2, а значит просто n.
Атомов кислорода слева и справа одинаковое количество. Справа их 2n из углекислого газа, потому что в каждой молекуле два атома кислорода, плюс n воды, итого 3n. Слева атомов кислорода столько же 3n, но один из атомов находится в молекуле альдегида, значит его надо вычесть из общего количества, чтобы получить количество атомов, приходящихся на молекулярный кислород. Выходит 3n-1 атомов содержит молекулярный кислород, а значит молекул в 2 раза меньше, потому как в состав одной молекулы входят 2 атома. То есть (3n-1)/2 молекул кислорода.
Таким образом, мы составили уравнение сгорания карбонильных соединений в общем виде.
И, наконец, двенадцатое свойство, относящееся к реакциям замещения галогенирование по альфа-атому углерода. Еще раз обратимся к строению молекулы альдегида. Кислород оттягивает на себя электронную плотность, создавая частичный положительный заряд а углероде. Метильная группа пытается компенсировать этот положительный заряд, смещая к нему электроны от водорода по цепи сигма-связей. Связь углерод-водород становится более полярной и водород легче отрывается при атаке реагентом. Такой эффект наблюдается только для альфа-атома углерода, то есть атома следующего за альдегидной группой, вне зависимости от длины углеводородного радикала.
Таким образом, возможно получение, например, 2-хлорацетальдегида. Возможно дальнейшее замещение атомов водорода до трихлорэтаналя.
Альдегидами называют органические вещества, относящиеся к карбонильным соединениям, содержащим функциональную группу -СОН, которая именуется карбонильной группой.
В зависимости от характера углеводородного скелета молекулы альдегиды бывают предельными, непредельными и ароматическими. Их молекулы могут также включать атомы галогенов или дополнительные функциональные группы. Общая формула насыщенных альдегидов имеет вид C n H 2 n O. В соответствии с номенклатурой ИЮПАК названия их оканчиваются суффиксом -аль.
Окисление альдегидов имеет важное значение в промышленности, поскольку они довольно легко превращаются в карбоновые кислоты. Окислителями в этом случае могут послужить гидроксид меди, оксид серебра или даже кислород воздуха.
Строение карбонильной группы
Электронное строение двойной связи в группе С=О характеризуется образованием одной σ-связи и еще одной π-связи. Атом С находится в состоянии sp 2 -гибридизации, молекула плоского строения с валентными углами между связями около 120 0 . Отличие двойной связи в этой функциональной группе заключено в том, что она расположена между атомом углерода и весьма электроотрицательным атомом кислорода. В результате электроны притянуты к атому О, а значит, эта связь очень сильно поляризована.
Содержание в альдегидной группе такой поляризованной двойной связи можно назвать главной причиной высокой реакционноспособности альдегидов. Для альдегидов наиболее характерны реакции присоединения атомов или их групп по С=О связи. И легче всего протекают реакции нуклеофильного присоединения. Также для альдегидов типичны реакции с участием атомов Н из функциональной группы альдегидов. Из-за электроноакцепторного влияния группы С=О происходит повышение полярности связи. Это в свою очередь является причиной относительно легкого окисления альдегидов.
Отдельные представители альдегидов
Формальдегид (муравьиный альдегид или метаналь) СН 2 О является газообразным веществом с весьма острым запахом, который получают обычно пропусканием смеси паров метанола с воздухом через раскаленную сетку из медной или серебряной сетки. Его 40%-й водный раствор называется формалином. Формальдегид легко вступает в реакции, многие из которых лежат в основе промышленного синтеза целого ряда важных веществ. Его используют и для получения пентаэритрита, многих лекарственных веществ, различных красителей, для дубления кожи, в качестве дезинфицирующего и дезодорирующего средства. Формальдегид довольно токсичен, его ПДК в воздухе составляет 0,001 мг/л.
Ацетальдегид (уксусный альдегид, этаналь) СН 3 СОН является бесцветной жидкостью с удушающим запахом, который при разбавлении его водой приобретает фруктовый аромат. Ацетальдегид обладает всеми основными свойствами альдегидов. Окислением уксусного альдегида производят огромные объемы уксусной кислоты и уксусного ангидрида, разнообразных фармацевтических препаратов.
Акролеин (пропеналь) CH 2 =CH-СОН, простейший ненасыщенный альдегид является бесцветной легколетучей жидкостью. Его пары сильно раздражают слизистые глаз и верхних дыхательных путей. Очень ядовит, ПДК его содержания в воздухе составляет 0,7 мг/м 3 . Пропеналь - промежуточный продукт синтеза некоторых полимеров, необходим в производстве отдельных лекарственных препаратов.

Бензальдегид (бензойный альдегид) С 6 Н 5 СОН является бесцветной желтеющей при хранении жидкостью с ароматом Он довольно быстро окисляется воздухом до бензойной кислоты. Содержится в эфирных маслах растений (нероли, пачулей), а в виде глюкозида - в ядрах косточек горького миндаля, вишни, абрикоса и персика. Как душистое вещество его применяют в парфюмерии, в виде компонента пищевых эссенций, как сырье для синтеза других душистых веществ (коричного альдегида, жасминальдегида).
Реакция серебряного зеркала
Окисление альдегидов оксидом серебра является самой показательной качественной реакцией на соответствующую форму функциональной группы. Свое название эта реакция получила благодаря тонкому серебряному налету на стенках пробирки, образующемуся в ходе этой реакции.
Суть ее заключается во взаимодействии альдегида R-СОН с аммиачным раствором оксида серебра(I), который представляет собой растворимое комплексное соединение OH и носит название реактив Толленса. Реакцию осуществляют при температурах, близких к температуре кипения воды (80-100 °С). При этом происходит окисление альдегидов до соответствующих им карбоновых кислот, а окислитель восстанавливается до металлического серебра, выпадающего в осадок.
Приготовление реактивов
Для качественного определения группы -СОН в альдегидах сначала готовят комплексное соединение серебра. Для этого в пробирку наливают немного раствора аммиака (гидроксида аммония) в воде и следом небольшое количество нитрата серебра. При этом образующийся осадок оксида серебра тут же исчезает:
2AgNO 3 + 2NH 3 + Н 2 О -> Ag 2 O↓ + 2NH 4 NO 3
Ag 2 O + 4NΗ 3 + Η 2 О -> 2ОΗ
Более надежные результаты дает реактив Толленса, приготовленный с добавлением щелочи. Для этого 1 г AgNO 3 растворяют в 10 г дистиллированной воды и добавляют равный объем концентрированного гидроксида натрия. В результате выпадает осадок Ag 2 O, который исчезает при добавлении концентрированного раствора гидроксида аммония. Использовать для проведения реакции нужно только свежеприготовленный реактив.

Механизм реакции
Реакции серебряного зеркала соответствует уравнение:
2OΗ + НСОΗ -> 2Ag↓ + ΗCOONΗ 4 + 3NΗ 3 + Н 2 О
Стоит отметить, что для альдегидов такое взаимодействие изучено недостаточно. Механизм данной реакции неизвестен, но предполагается радикальный или же ионный вариант окисления. По гидроксиду диамминсеребра вероятнее всего реализуется присоединение с образованием серебряной соли диола, от которого затем отщепляется серебро с образованием карбоновой кислоты.
Для успешного проведения опыта чрезвычайно важна чистота используемой посуды. Связано это с тем, что образующиеся в ходе опыта коллоидные частицы серебра должны прицепиться к поверхности стекла, создав зеркальную поверхность. В присутствии малейших загрязнений оно будет выпадать в виде серого хлопьевидного осадка.
Для очистки емкости следует использовать растворы щелочей. Так, для этих целей можно взять раствор NaOH, который нужно смыть большим объемом дистиллированной водой. На поверхности стекла не должно присутствовать жировых следов и механических частиц.
Окисление гидроксидом меди
Реакция окисления альдегидов гидроксидом меди (II) также довольно эффектна и эффективна в определении типа функциональной группы. Протекает она при температуре соответствующей кипячению реакционной смеси. При этом альдегиды восстанавливают двухвалентную медь в составе реактива Фелинга (свежеприготовленный аммиачный раствор Cu(OH) 2) до одновалентной. Сами же они окисляются по причине внедрения атома кислорода по связи С-Η (степень окисления С изменяется с +1 на +3).
Визуально за ходом реакции можно проследить по изменению окраски смеси растворов. Голубоватый осадок гидроксида меди постепенно превращается желтый, соответствующий гидроксиду меди одновалентной и дальнейшее появление яркого красного осадка Cu 2 O.
Этому процессу соответствует уравнение реакции:
R-СОН + Cu 2+ + NaOH + Н 2 О -> R-COONa + Cu 2 O + 4Н +

Действие реактивом Джонса
Стоит отметить, что на альдегиды такой реактив действует наилучшим образом. В этом случае окисление не требует нагревания и проводится при температуре 0-20 °С в течение довольно короткого отрезка времени, а выход продуктов составляет больше 80%. Главным недостатком реагента Джонса состоит в отсутствии высокой избирательности в отношении других функциональных групп, да к тому же кислая среда порой приводит к изомеризации или деструкции.
Реагент Джонса представляет собой раствор оксида хрома (VI) в разбавленной и ацетоне. Его также можно получить из дихромата натрия. При окислении альдегидов образуются под действием этого реактива карбоновые кислоты.
Промышленное окисление кислородом
Окисление ацетальдегида в промышленности осуществляют воздействием кислорода в присутствии катализаторов - ионов кобальта или марганца. Сначала образуется надуксусная кислота:
СН 3 -СОН + О 2 -> СН 3 -СОООН
Она в свою очередь взаимодействует со второй молекулой уксусного альдегида и через перекисное соединение дает две молекулы уксусной кислоты:
СН 3 -СОООН + СН 3 -СОН -> 2СН 3 -СООН
Окисление ведется при температуре 60-70 °С и давлении 2·10 5 Па.
Взаимодействие с раствором йода
Для окисления альдегидных групп иногда применяется раствор йода в присутствии щелочи. Особое значение этот реактив имеет в процессе окисления углеводов, поскольку действует очень избирательно. Так под его влиянием D-глюкоза превращается в D-глюконовую кислоту.

Йод в присутствии щелочей образует гипойодид (весьма сильный окислитель): I 2 + 2NaOΗ -> NaIO + NaI + Н 2 О.
Под действием гипойодида формальдегид превращается в метановую кислоту: ΗСОΗ + NaIO + NaOΗ -> ΗCOONa + NaI + Н 2 О.
Окисление альдегидов йодом используют в аналитической химии для определения количественного их содержания в растворах.
Окисление диоксидом селена
В отличие от предыдущих реактивов, под действием диоксида селена альдегиды превращаются в дикарбонильные соединения, а из формальдегида образуется глиоксаль. Если рядом с карбонилом расположены метиленовые или метильные группы, то они могут превращаться в карбонильные. Как растворитель для SeO2 обычно используют диоксан, этанол или ксилол.
По одной из методик реакцию проводят в трехгорлой колбе, соединенной с мешалкой, термометром и обратным холодильником. К исходному веществу, взятому в количестве 0,25 моль, каплями прибавляют раствор 0,25 моль диоксида селена в 180 мл диоксана, а также 12 мл Н 2 О. Температура не должна превышать 20 °C (при необходимости колбу охлаждают). После этого при постоянном перемешивании раствор кипятят в течении 6 часов. Далее горячий раствор фильтруют для отделения селена и промывают осадок диоксаном. После вакуумной отгонки растворителя остаток фракционируют. Основную фракцию отбирают в широком температурном интервале (20-30 °C) и повторно ректифицируют.

Аутоокисление альдегидов
Под действием кислорода воздуха при комнатной температуре окисление альдегидов происходит очень медленно. Главными продуктами этих реакций являются соответствующие карбоновые кислоты. Механизм аутоокисления родственен промышленному окислению этаналя до уксусной кислоты. Одним из промежуточных продуктов является надкислота, которая взаимодействует с еще одной молекулой альдегида.
Благодаря тому, что этот тип реакций ускоряется под действием света, перекисей, и следов тяжелых металлов, можно сделать вывод о ее радикальном механизме. Формальдегид в водных растворах значительно хуже своих собратьев окисляется воздухом, из-за того, что существует в них в виде гидратированного метиленгликоля.

Окисление альдегидов перманганатом калия
Наиболее успешно эта реакция происходит в Визуально оценить ее прохождение можно по потере интенсивности и полному обесцвечиванию розовой окраски раствора марганцовки. Реакция проходит при комнатной температуре и нормальном давлении, поэтому она не требует особых условий. Достаточно в пробирку налить 2 мл формальдегида и 1 мл подкисленного серной кислотой Пробирку с раствором нужно осторожно встряхнуть для перемешивания реагентов:
5СН 3 -СОН + 2KMnO 4 + 3H 2 SO 4 = 5СН 3 -СООН + 2MnSO 4 + K 2 SO 4 + 3Н 2 О
Если ту же реакцию вести при повышенных температурах, то метаналь легко окисляется до углекислого газа:
5СН 3 -СОН + 4KMnO 4 + 6H 2 SO 4 = 5СО 2 + 4MnSO 4 + 2K 2 SO 4 + 11Н 2 О